Efectos Toxicológicos e Impacto Ambiental del Mercurio (página 2)
El metilmercurio y la tragedia de
Minamata
La enfermedad de Minamata es un síndrome
neurológico grave y permanente causado por envenenamiento
con mercurio. Los síntomas incluyen ataxia,
alteración sensorial en manos y pies, deterioro de
los sentidos
de la vista y el oído,
debilidad y, en casos extremos, parálisis y muerte.
La enfermedad de Minamata se denomina así porque
la ciudad de Minamata (Japón)
fue el centro de un brote de envenenamiento por metilmercurio en
la década de los 50. En 1956, el año que se
detectó el brote, murieron cuarenta y seis
personas.
Entre 1953 y 1965 se contabilizaron 111 víctimas
y más de 400 casos con problemas
neurológicos. Madres que no presentaban ningún
síntoma dieron a luz niños
gravemente afectados.
En 1968, el gobierno
japonés anunció oficialmente que la causa de la
enfermedad era la ingestión de pescado y de marisco
contaminado de mercurio por los vertidos de la empresa
petroquímica Chisso. Se calcula que entre
1932 y 1968, año en que cambió el proceso de
síntesis por otro menos contaminante, se
vertieron a la bahía 81 toneladas de mercurio.
En el año 2001 se habían diagnosticado
2.955 casos de la enfermedad de Minamata.
El reportaje gráfico de W. Eugene Smith atrajo la
atención del mundo hacia la enfermedad de
Minamata.

W. Eugene Smith (Tomoko Uemura en su
tina. Minamata, 1972)
Efectos ambientales del mercurio
El mercurio entra en el ambiente como
resultado de la ruptura de minerales de
rocas y suelos a
través de la exposición
al viento y agua. La
liberación de mercurio desde fuentes
naturales ha permanecido en el mismo nivel a través de los
años, sin embargo el incremento de las concentraciones de
mercurio en el medioambiente en las últimas décadas
indica la actividad humana.
La mayoría del mercurio liberado por las
actividades humanas es liberado al aire, a
través de la quema de productos
fósiles, minería,
fundiciones y combustión de residuos
sólidos.
Otras formas de contaminación son directamente al suelo o al agua,
por ejemplo la aplicación de fertilizantes en la agricultura y
los vertidos de aguas residuales industriales. Todo el mercurio
que es liberado al ambiente eventualmente terminará en
suelos o aguas superficiales.
Aguas superficiales ácidas pueden contener
significantes cantidades de mercurio. Cuando los valores de
pH
están entre 5 y 7, las concentraciones de mercurio en
el agua se
incrementarán debido a la movilización del mercurio
en el suelo. El mercurio que ha alcanzado las aguas superficiales
o suelos los microorganismos pueden convertirlo en metilmercurio.
Los peces absorben
gran cantidad de metilmercurio de agua superficial cada
día.
Las emisiones de mercurio procedentes de fuentes
naturales incluyen el medio ambiente
marino y acuático, así como de la actividad
volcánica y geotérmica. Sin embargo, estudios
recientes, sugieren que las fuentes antropogénicas
contribuyen a la liberación de la mayor parte del
mercurio, y que la carga total de mercurio atmosférico se
ha multiplicado por un factor entre 2 y 5 desde el comienzo de la
era industrial. Aproximadamente un tercio de las emisiones
totales del mercurio global actual circulan en un ciclo cerrado
entre los océanos y la atmósfera, pero se
cree que mucho menos del 50 por ciento de las emisiones
oceánicas proceden del mercurio originalmente movilizado
por fuentes naturales. La recirculación de mercurio a la
superficie de la tierra,
especialmente desde los océanos, extiende la influencia y
el tiempo de
actividad de las emisiones antropogénicas de
mercurio.

Los científicos consideran que las deposiciones
atmosféricas de mercurio emitidas al aire por
combustión, incineración o procesos de
manufactura,
contribuyen en una parte muy importante al mercurio que se
encuentra en las aguas y el suelo. En Minnesota (EEUU), los
investigadores estiman que en 1995, las liberaciones directas de
la industria a
las aguas superficiales contribuyeron solamente en el 1 o 2 por
ciento del contenido en mercurio de dichas aguas, mientras que
fueron responsables del 98% de las deposiciones
atmosféricas.
El análisis ha encontrado que cada año
unas 49 toneladas de mercurio se emiten directamente al aire por
cientos de centrales térmicas en los Estados Unidos de
América, confirmado las más
recientes estimaciones gubernamentales de contaminación
por mercurio. El estudio también ha hallado que una
cantidad similar de mercurio –unas 40 toneladas- se acumula
en los residuos de la planta cuando los filtros diseñados
para capturar azufre y otros contaminantes atmosféricos
retienen una porción del mercurio contenido en los
gases emitidos
por las chimeneas. Una contaminación adicional, estimada
en 10 toneladas, se produce durante el lavado del carbón
previo a su consumo en las
centrales térmicas.
Espectrometría de absorción
atómica
Espectroscopia de absorción atómica en
llama
La espectroscopia de absorción atómica
(AA), tiene como fundamento la absorción de radiación
de una longitud de onda determinada. Esta radiación es
absorbida selectivamente por átomos que tengan niveles
energéticos cuya diferencia en energía corresponda
en valor a la
energía de los fotones incidentes. Los componentes
instrumentales de un equipo de espectrofotometría de
absorción atómica son los similares a los de un
fotómetro, excepto que en AA se requiere de una fuente de
radiación necesaria para excitar los átomos del
analito. Estos componentes se representan en la Figura
1.

Figura 1 – Componentes de un
Espectrofotómetro de Absorción
Atómica.
Componentes de un espectrofotómetro de
absorción atómica
1) Una fuente de radiación que emita una
línea específica correspondiente a la necesaria
para efectuar una transición en los átomos del
elemento analizado. (Lámpara)
2) Un nebulizador, que por aspiración de la
muestra
líquida, forme pequeñas gotas para una
atomización más eficiente.
3) Un quemador, en el cual por efecto de la temperatura
alcanzada en la combustión y por la reacción de
combustión misma, se favorezca la formación de
átomos a partir de los componentes en
solución.
4) Un sistema
óptico que separe la radiación de longitud de onda
de interés, de todas las demás
radiaciones que entran a dicho sistema. (Monocromador y red de
difracción)
5) Un detector o transductor, que sea capaz de
transformar, en relación proporcional, las señales
de intensidad de radiación electromagnética, en
señales eléctricas o de intensidad de
corriente.
6) Un amplificador o sistema electrónico, que
como su nombre lo indica amplifica la señal
eléctrica producida, para que en el siguiente paso pueda
ser procesada con circuitos y
sistemas
electrónicos comunes.
7) Por último, se requiere de un sistema de
lectura en el
cual la señal de intensidad de corriente, sea convertida a
una señal que el operario pueda interpretar (ejemplo:
absorbancia). Este sistema de lectura, puede ser una escala de aguja,
una escala de dígitos, un graficador, una serie de
datos que
pueden ser procesados a su vez por una computadora,
etc.
La AA en llama es a la fecha la técnica
más ampliamente utilizada para determinar elementos
metálicos y metaloides. Esta técnica tienen grandes
convenientes y es de costo
relativamente bajo, pudiéndose aplicar tal técnica
a una gran variedad de muestras.
Acoplado un instrumento de absorción
atómica a un horno de grafito o a un generador de hidruros
se alcanzan límites de
detección hasta de ppb, lo cual lo hace indispensable en
áreas como son: estudios de contaminación ambiental, análisis de
alimentos,
análisis de aguas potables y residuales, diagnóstico clínico, etc.
Fundamentos de funcionamiento
La muestra a analizar debe ser previamente tratada para
asegurar que todos los iones a determinar se encuentren libres en
solución, en el caso de muestras acuosas este no es el
problema pero en el caso de alimentos u otras matrices
sólidas debe realizarse un tratamiento previo de
mineralización.
La solución a analizar se hace pasar a
través del mechero, por medio de aspiración en
forma de niebla gracias al sistema de nebulizador. Los iones y
átomos son excitados por la energía recibida en la
llama y al ser atravesados por el haz de luz proveniente de la
lámpara absorben parte de la energía necesaria para
volver a su estado
electrónico fundamental.
Un monocromador compuesto por una red de difracción
selecciona la longitud de onda específica del
elemento.
La diferencia entre la cantidad de energía
proveniente de la lámpara que llega al detector
inicialmente y mientras la muestra lo atraviesa es una medida
cuantificable al alcanzar el amplificador y registrador del
equipo.
La señal se traduce en unidades de
concentración del analito mediante una lectura previa de
una curva de calibración del analito deseado e
interpolando los valores
obtenidos. Un esquema general del funcionamiento del equipo de
absorción atómica se observa en la figura
2.

Figura 2 – Funcionamiento general
del Espectrofotómetro de Absorción
atómica
Técnica de vapor frío
La técnica de vapor frío se utiliza
solamente para el caso del análisis de mercurio, debido a
que aprovecha la facultad del mercurio de emitir vapores
monoatómicos a temperatura ambiente. Debido a que el mismo
posee una presión de
vapor elevada no es necesario la utilización de un
nebulizador para atomizar la muestra ni de entregarle la
energía de una llama.
Por tal motivo el esquema y los componentes del
espectrofotómetro son los mismos con la excepción
que no es necesario la utilización de estos dos elementos
(mechero y nebulizador). En su lugar se utiliza un dispositivo
que consta de un recipiente donde se ponen en contacto la muestra
acidificada con una solución de borohidruro de Na que
actúa como reductor.
En este mutuo contacto se verifican las siguientes
reacciones químicas:
BH4+ +
3H2O + H+ à
BO3-3 + 4H2
H2 + Hg++ à
2H+ + Hgº
El Hg elemental producido es arrastrado en forma de
vapor por medio de una corriente de un gas inerte como
Ar o N2 a una celda de cuarzo interpuesta sobre el
paso óptico. Dependiendo de la cantidad de Hg que posea la
muestra y, por lo tanto, llegue a la celda, este absorberá
más o menos de la energía proveniente de la
lámpara traduciéndose en señal de
absorbancia.
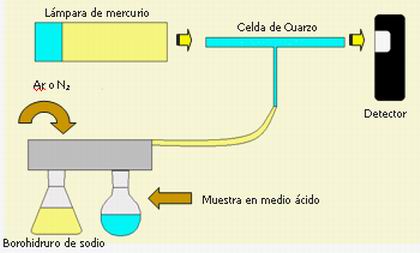
Figura 3 – Esquema de determinación de Hg
por
Espectrofotometría de AA – vapor
frío
Legislación
actual y estudios previos
Normativa vigente y niveles permitidos
Dependiendo de los tipos de aguas y de las leyes vigentes
existen diferentes niveles de Hg permitidos:
Código Alimentario | Disposición Nacional | Ley Provincial 11220 Anexo A y B | Codex Alimentarius (Europa) | Agencia de protección | |
Agua potable | 1 μg/l | – | 1 μg/l | 1 μg/l | 2 μg/l |
A colectora cloacal | – | 5 μg/l | 5 μg/l | – | – |
A curso de agua | – | 5 μg/l | – | – | – |
A conducto pluvial | – | 5 μg/l | – | – | – |
Antecedentes de Estudios ambientales en el Arroyo
Saladillo
De acuerdo a publicaciones de Marzo de 2003 del Diario
La Capital y
Barrameda.com.ar (Grupo que
tiene por objeto la publicación de materiales de
interés general) en dicho mes se analizaron muestras de
aguas de los Arroyos Saladillo y Ludueña, ubicados en el
sur de la provincia de Santa Fe – Argentina, presentando
valores elevados de Pb y Hg así como de actividad
bacteriana. A continuación se adjunta parte de la
publicación:
EL SALADILLO Y EL Lo confirma una muestra realizada |
Una muestra analizada por la Universidad
Nacional de Rosario (UNR) demostró que los niveles de
contaminación de plomo y mercurio en los arroyos Saladillo
y Ludueña son alarmantes: los máximos permitidos
resultan ínfimos en relación a la presencia de
estos compuestos químicos que alteran la fauna costera y
comprometen la salud de los barrios asentados cerca de estos
cursos de agua.
El análisis bacteriológico
y toxicológico de ambos arroyos se realizó el 6 de
marzo pasado, a nivel superficial, por los integrantes de la
comunidad del Centenario.
Según la ley Nº
24.051, (de calidad del agua)
los niveles tolerables de plomo nunca deberían superar el
microgramo por cada litro, pero en el Saladillo asciende a 14
microgramos por litro, y a 15 en el Ludueña.
Con el mercurio ocurre lo mismo. La
norma acepta sólo 0,1 microgramo por litro, en el
Saladillo llega a los 2,52, y a 1,75 en el
Ludueña.
8 de abril de 2003 –
Fuente: Diario La Capital
Este nivel de mercurio para el Arroyo Saladillo de 2.52
ug/l superaría el máximo tolerable de agua potable
de todas las normas vigentes
de 1 ug/l, poniendo en riesgo las
poblaciones aledañas por consumo o ingesta de peces como
de los factores ambientales ya mencionados. De acuerdo al
análisis a realizarse se evaluará que nivel de Hg
está presente en la actualidad.
Desarrollo del
análisis de Hg total en agua superficial del Arroyo
Saladillo
Muestreo
El muestreo se
realizó sobre la superficie del Arroyo Saladillo a aprox.
400 metros de su desembocadura con el Río Paraná.
Este se realizó el día 17 de mayo de 2007 a las
8:30hs AM. Luego de la toma se determinó temperatura y pH
arrojando los siguientes valores:
- Temperatura: 15ºC
- pH: 7.34
El análisis se realizó sobre muestra total
sin filtrar, determinándose de esta manera Hg total y no
disuelto.

Técnica analítica
Fundamento
Previa oxidación y mineralización, el
mercurio se libera de la solución por reducción y
posterior arrastre con una corriente de nitrógeno hacia la
celda de cuarzo interpuesta sobre el paso óptico para su
lectura.
Método
Espectrofotometría de Absorción
Atómica por vapor frío.
Equipamiento
- Espectrofotómetro de Absorción
Atómica – Perkin Elmer Aanalyst 200 - Generador de hidruros y vapor frío
–Perkin Elmer FIAS 100Patrones
Solución patrón de Hg
inorgánico de 1000 mg/l, con certificado de calidad
trazable a NIST.Reactivos y soluciones
- Lámpara de Hg de descarga sin electrodo
(EDL) - Agua destilada Calidad Ultra pura Tipo 1.
Conductividad: <0.2 m
S/cm2. - HNO3 65% P.A. Bajo en Hg.
- H2SO4 98% P.A. Bajo en
Hg - HCl 36% P.A.
- NaOH PA.
- KMnO4 P.A. Bajo en Hg
- Borohidruro de sodio PA Mín 95 %
- Clorhidrato de hidroxilamina P.A. Bajo en
Hg
- Solución de KMnO4 al 6% P/V:
Pesar 60 g de KMnO4 P.A. y disolver en agua
destilada calidad ultra pura. Llevar a 1000 ml con agua
destilada en matraz aforado. - Solución de Clorhidrato Hidroxilamina al
15%: Pesar 15 g de Clorhidrato de hidroxilamina P.A. llevar
a 100 ml con agua destilada calidad ultra pura en matraz
aforado. - Solución reductora de Borohidruro de
Sodio: Pesar 0.5 g de NaOH y 2 g de borohidruro de sodio.
Disolver en una pequeña porción de agua destilada
ultra pura y llevar a volumen en
matraz aforado de 1000 ml con agua destilada de la misma
calidad. La solución se prepara y utiliza en el
día. - Solución de HCl al 3%: Disolver 30 ml
de HCl PA conc, medidos con probeta graduada de 50 ml, en agua
destilada ultra pura y llevar a 1000 ml en matraz
aforado.
Soluciones patrones y curva de
calibración
- Solución intermedia de 10 mg/l de Hg:
Pipetear con micropipeta calibrada 1000 ul de solución
patrón de Hg de 1000 ppm en matraz aforado de 100 ml,
agregar 2 ml de HNO3 conc y enrasar a volumen con
agua destilada calidad ultra pura. - Solución de trabajo de
200 ug/l de Hg: Pipetear con bolpipeta clase A 2 ml
de solución intermedia de 10 ppm de Hg en matraz aforado
de 100 ml, agregar 2 ml de HNO3 conc y 3 gotas de
solución de KMnO4 al 6%. Enrasar a volumen
con agua destilada ultra pura. - Preparar curva de calibración de acuerdo a
la Tabla siguiente:
ANALITO | CONCENTRACIÓN DE LA | VOLUMEN TOMADO DE LA | VOLUMEN DE HNO3 CONC. | VOLUMEN KMnO4 6% | VOL. FINAL (ml) | CONCENTRACIÓN FINAL |
Hg | 200 | 1000 | 2 | 3 | 50 | 4.00 |
Hg | 200 | 500 | 2 | 3 | 50 | 2.00 |
Hg | 200 | 250 | 2 | 3 | 50 | 1.00 |
Hg | 200 | 125 | 2 | 3 | 50 | 0.50 |
Hg | 200 | 62.5 | 2 | 3 | 50 | 0.25 |
Hg | – | – | 2 | 3 | 50 | 0.00 |
Nota: El agregado de solución de
KMnO4 a las soluciones
diluidas de Hg tiene por objetivo
mantener un medio oxidante tal que el ión Hg permanezca en
estado libre y evitar su unión a moléculas
orgánicas presentes en las soluciones.
Procedimiento
Preparación de muestras:
Tomar 20 ml de muestra con bolpipeta clase A en tubo
Falcon de 50 ml. Agregar 1 ml de HNO3 conc, 1 ml de
H2SO4 conc. y 2 ml de solución de
KMnO4 al 6 %.
Tapar y llevar a baño de agua a 90-95º C
durante 2 horas. Dejar enfriar a temp. ambiente y agregar gotas
de hidroxilamina al 20 % hasta desaparición total de
coloración y presencia de MnO2.
Llevar a 25 ml con agua destilada calidad ultra
pura.
Preparación de blanco de
reactivos:
Realizar los mismos pasos que en la preparación
de la muestra, pero utilizar agua destilada calidad ultra pura en
reemplazo de la muestra.
Preparación de muestras
fortificadas:
Preparar muestras fortificadas para evaluar el % de
recuperación del método y
aplicar el factor de corrección correspondiente a las
muestras.
Para esto tomar 20 ml de muestra con bolpipeta clase A
en tubo Falcon de 50 ml. Fortificar agregando con micropipeta,
125 ul de solución de trabajo de 200 ug/l de
Hg.
Agregar 1 ml de HNO3 conc, 1 ml de
H2SO4 conc. y 2 ml de solución de
KMnO4 al 6 %.
Tapar y llevar a baño de agua a 90-95º C
durante 2 horas. Dejar enfriar a temp. ambiente y agregar gotas
de hidroxilamina al 15 % hasta desaparición total de
coloración y presencia de MnO2.
Llevar a 25 ml con agua destilada calidad ultra
pura.
Estas muestras fortificadas poseen una conc. final de 1
ug/l.
Cálculos
![]()
donde:
µg/l: concentración arrojada por el equipo
al extrapolar la absorbancia de la muestra a la curva de
calibración
Fd: factor de dilución de la muestra
![]()
En este caso 25/20, o sea, 1.25.
Fc: factor de corrección, obtenido de la
recuperación del analito en las muestras fortificadas,
este se obtiene de la siguiente manera:
![]()
A: Conc. de Hg hallada en muestra
fortificada
B: Conc. de Hg nominal en muestra fortificada, en este
caso 1 ug/l.
C: Conc. de Hg en la muestra incógnita, debido a
que se fortificó sobre la muestra
incógnita.
Expresión de resultados
Los resultados se expresan en µg/l de Hg sobre la
muestra.
Limite de cuantificación
0.25 µg/l, correspondiente a la
concentración menor de la curva de
calibración.
Resultados
obtenidos
Curva de calibración
Los resultados obtenidos de la lectura de
la curva de calibración arrojó los siguientes
resultados:
- Tipo: Lineal a través del cero.
- Rango de linealidad: 0.25 – 4.00
ug/l - Ajustada a blanco de curva
- Pendiente: 0.25223
- Ordenada al origen: 0
- Coef. de correlación: 0.999329
Blanco de reactivos y muestras
- Se ajustó la señal con el blanco de
reactivos. - Se procedió a la lectura de las 10 muestras
previa preparación. - Todas las muestras presentaron valores no
detectables ni cuantificables.
Muestras fortificadas
- Se realizaron 3 muestras fortificadas, presentando
los siguientes resultados y el siguiente análisis
estadístico:

- Del % de recuperación obtenido, si el
resultado de las muestras hubiera sido positivo y cuantificable
el factor de corrección (fc) utilizado en el cálculo
del resultado final habría sido 0.96.
Análisis estadístico de los
resultados
- No es posible realizar un análisis
estadístico del paquete de resultados, así como
estudio de valores anómalos (aberrantes) por los
Test de
Grubbs y Cochrann.
Conclusiones
- Los resultados de las 10 alícuotas analizadas de
la muestra tomada del Arroyo Saladillo presentaron ausencia
de Hg en este cauce.- el buen nivel de recuperación de las
muestras fortificadas (96%), - la adecuada repetibilidad en las muestras
fortificadas (%CV: 4.54), - el coeficiente de correlación de la curva
de calibración (r2:
0.999329), - el nivel del analito en el blanco de reactivos es
inferior al punto más bajo de la curva de
calibración (0.20 ug/l).
- el buen nivel de recuperación de las
- El método analítico empleado es confiable
debido a:- No se conoce el punto de muestreo de la muestra
tomada en marzo de 2003 y por lo tanto se desconocen
posibles fuentes de contaminación cercanas que
pudieron aportar analito a la muestra. - La muestra presente de resultado negativo fue
tomada el 17 de mayo de 2007, aproximadamente 45
días después del temporal de lluvia que se
mantuvo durante 6 días consecutivos y que
provocó inundaciones, anegamientos generales y una
suba en el nivel del arroyo en más de 2.5 metros de
la media normal. Esta crecida, motivó una fuerte
corriente de agua de "lluvia" desde el arroyo hacia el
Paraná, que "lavó" el cauce del arroyo por
arrastre hacia el río. Muchos de estos contaminantes
arrastrados, el mercurio entre ellos, tardarán un
tiempo considerable en concentrarse nuevamente sea por el
aporte ambiental, el volcado industrial o por transferencia
de mercurio desde el barro o sedimento al seno del
líquido.
- No se conoce el punto de muestreo de la muestra
- Analizando los valores de Hg sobre el Saladillo
publicados en marzo del 2003 de 2.52 ug/l y el resultado
negativo de la muestra actual se pueden plantear las siguientes
hipótesis:
Referencias
Bibliográficas
- http://es.wikipedia.org/wiki/Enfermedad_de_Minamata
http://www.ecoloxistesasturies.org/Temas/Mercurio/Mercurio%20en%20CT/Mercurio_en_termicas.htm
http://www.ecoloxistesasturies.org/Temas/Mercurio/Varios/Introduccion.htm
http://www.lenntech.com/espanol/tabla-peiodica/Hg.htm#Efectos%20ambientales%20del%20mercurio- http://es.wikipedia.org/wiki/Espectroscopia_de_absorci%C3%B3n_at%C3%B3mica
- SKOOG, D.A. James; Holler F. James; PRINCIPIOS DE
ANÁLISIS INSTRUMENTAL, 5° ed.; Ed. McGraw-Hill
(1998), págs. 219-239. - Ministerio de Desarrollo
Social y Medio Ambiente – Secretaría de Desarrollo
Sustentable y Política Ambiental
Manual de
tecnologías de medición de concentración de gases
y material particulado en chimeneas y atmósfera Dr.
Jaime A. Moragues - Ley provincial Nº 11220 –
ENRESS
http://www2.medioambiente.gov.ar/mlegal/agua/disp79179_90_anxa.htm-Disp.
Nac. 79179/90 – OSN- Código alimentario argentino – Cap. XII
– Bebidas hídricas, agua y agua
gasificada.
http://www.epa.gov/safewater/contaminants/dw_contamfs/mercury.html- Codex alimentarius STAN 108-1981 – Norma del
codex para las aguas minerales naturales - Métodos normalizados para el análisis
de aguas y efluentes. APHA - http://www.barrameda.com.ar
Datos del autor
Ismael Pablo Antuña
Lugar de Residencia: Rosario –
Santa Fe – Argentina
Profesión y experiencias:
- Químico Analista
- Investigación y Desarrollo
de técnicas
analíticas para control y
análisis de alimentos, aguas, efluentes, etc. de
metales
pesados, micotoxinas, plaguicidas, fungicidas, etc. - Manejo y puesta a punto de instrumental
analítico de alta precisión (Cromatografía liquida y gaseosa,
espectrofotometría UV-Vis y de absorción
atómica) - Estudios y experiencia de validaciones y sistemas de
control de calidad de ensayos
químicos bajo sistema de calidad ISO
17025:2005.
Datos del trabajo
Lugar: Rosario – Santa Fe –
Argentina
Fecha: Mayo de 2007
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |